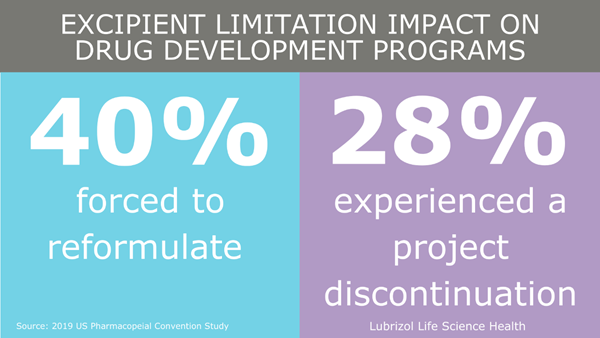
A seleção e qualificação de excipientes (ingrediente inativo) para utilização em um medicamento são fundamentais para o sucesso de qualquer programa de desenvolvimento farmacêutico. Excipientes farmacêuticos são substâncias diferentes do ingrediente ativo que foram avaliadas em termos de segurança e são incluídas intencionalmente em um sistema de entrega de medicamento. Excipientes são vitais para garantir propriedades essenciais de medicamentos como o aumento da biodisponibilidade ou a possibilidade de liberar um medicamento de forma controlada.
No entanto, o cenário regulatório atual ou a falta de um caminho independente de aprovação de excipientes pode estar limitando a entrada de novos excipientes no mercado e, consequentemente, novos medicamentos. Nos reunimos com a Diretora de Estratégia e Política Regulatória da Lubrizol Life Science Health (LLS Health), Meera Raghuram, para discutir a importância de novos excipientes e de ações recentes tomadas pelo FDA.
P: O que é um novo excipiente e como um excipiente é aprovado?
"Bem, para começar, é um equívoco comum acreditar que os excipientes são 'aprovados', diz Meera. "Os próprios ingredientes ativos nunca são aprovados pela FDA. Excipientes são analisados como um componente do medicamento acabado quando uma solicitação de novo medicamento (NDA), solicitação abreviada de novo medicamento abreviado (ANDA) ou solicitação 505(b)(2) é enviada. Isso define a precedência de utilização do excipiente em um medicamento aprovado e, portanto, o excipiente já não é mais considerado 'novo' nessa via de administração específica, aos níveis de ingestão diária máximos aprovados."
Um novo excipiente geralmente se refere a um ingrediente inativo que não foi usado anteriormente em um medicamento aprovado nos Estados Unidos. No entanto, os reguladores podem ver um excipiente que não foi usado em uma determinada via de administração específica ou em níveis acima do precedente em um medicamento aprovado como "novo". Mesmo que um excipiente tenha sido usado abrangentemente em outras aplicações não farmacêuticas aprovadas pela FDA, como produtos alimentícios ou que não requerem prescrição médica, ainda é considerado "novo" quando usado em medicamentos sujeitos à aprovação regulatória. Em geral, fabricantes de medicamentos relutam em usar um novo excipiente em um medicamento, pois não se sabe ao certo se a FDA consideraria adequadas as informações de segurança disponíveis sobre um excipiente. Essa incerteza é maior com medicamentos genéricos, pois estudos não clínicos e clínicos não são exigidos para aprovações regulatórias.
"Como atualmente não existe nenhum caminho para a avaliação independente de excipientes, somente quando um excipiente está presente em um medicamento aprovado é que deixa de ser considerado novo e aparecerá no banco de dados de ingredientes inativos (IID) da FDA", observa Meera.
P: O que é banco de dados de ingredientes inativos (IID)?
O IID é um repositório importante de informações de excipientes que um desenvolvedor de medicamentos pode usar para avaliar possíveis ingredientes inativos para a sua formulação. Esse banco de dados fornece informações sobre a potência máxima por dose unitária do excipiente em medicamentos aprovados nos Estados Unidos para determinada via de administração.
"Uma vez que um excipiente consta no banco de dados, ele exigirá uma análise menos extensa do FDA na próxima vez que for incluído em um tipo semelhante de medicamento, pois a precedência de uso e segurança para determinada via de administração já foi estabelecida", comenta Meera. "É compreensível que isso geralmente leva os desenvolvedores a usar somente ingredientes que constam no IID, mesmo que nem todos os aspectos de desempenho ideal do medicamento possam ser alcançados."
P: É um problema usar somente excipientes que constam no IDD?
P: O que a FDA está fazendo para remediar a situação e que função o setor está desempenhando?
"Com base em discussões com vários stakeholders e suas preocupações expressadas, a FDA está considerando desenvolver um programa piloto para a avaliação toxicológica e de qualidade de novos excipientes e tem buscado informações de stakeholders. O programa seria voluntário e permitiria a análise de uma quantidade limitada de submissões por ano. Fornecedores e usuários de excipientes, incluindo a Lubrizol Life Science Health e associações do setor, enviaram comentários em resposta ao programa proposto pela FDA com a maioria apoiando o programa. O apoio avassalador parece provar a necessidade definitiva de um programa de novos excipientes como este."
P: Quais são os possíveis benefícios de um programa de análise de novos excipientes?
"Um programa como este poderia desbloquear um potencial anteriormente inexplorado no que diz respeito a novos produtos e opções de tratamento. O reconhecimento regulatório desses importantes novos excipientes em estágio inicial no desenvolvimento incentivaria a consideração mais disseminada de sua aplicação, criando mais versatilidade na entrega de medicamentos e método de fabricação", diz Meera.
Como resumido nos comentários enviados à FDA, possíveis benefícios para futuros medicamentos como resultado do programa de análise de novos excipientes podem incluir:
- Desempenho aprimorado de produtos em termos de estabilidade, solubilidade, entrega etc.
- Redução de custos de desenvolvimento em geral, o que pode garantir o acesso mais rápido e acessível de pacientes a novas terapias
- Potencial para estender a liberação do medicamento por períodos de tempo mais longos ou para uma administração mais direcionada, resultando em melhor adesão do paciente
- Mais opções de formulações com produtos combinados ou ao adaptar medicamentos para uma nova forma farmacêutica ou via de administração
- Novos recursos para evitar o abuso de medicamentos com o uso incorreto pelo paciente, como opioides
P: O que a Lubrizol Life Science Health está fazendo em termos de novos excipientes?
"A Lubrizol Life Science Health oferece uma variedade de excipientes em uma grande quantidade de formas farmacêuticas, muitas das quais constam no IID e têm precedência de uso em medicamentos aprovados. Estamos empenhados em nos juntar aos nossos clientes para colocar as melhores opções de tratamento no mercado. É fundamental garantir que possuam opções adequadas de ingredientes inativos e é por isso que apoiamos a criação deste novo programa da FDA", observa Meera.
Muitos excipientes da Lubrizol Life Science Health ainda não constam no IID, mas têm potencial de oferecer benefícios significativos para formulações. Alguns deles incluem:
- Adesão aprimorada a membranas mucosas ou biológicas (mucoadesão ou bioadesão)
- Maior controle na liberação de medicamento e penetração aprimorada no tecido pretendido
- Maior versatilidade no processamento, como com polímeros que permitem a fácil dispersão em água ou podem ser transformados diretamente em comprimidos (Carbopol® Ultrez 10 e 71G NF)
- Maior controle reológico e modificação da viscosidade com estética e sensação ideais
Autores:
Meera Raghuram | Diretora, estratégia regulatória e política
Ashley M. Rein | Especialista técnica em marketing
Referências: